高品質な製品の安定供給のためのグループ連携
基本的な考え方
大塚グループは、すべての人々に信頼される安全・安心な製品を安定供給することを責務としています。法令や行政・業界基準(医薬品医療機器等法、食品衛生法、食品表示法など)に準拠するとともに「ISO9001(品質)」「ISO22000」「FSSC22000」(食品安全)などの認証の取得を進め、大塚グループとしての「品質ポリシー」を掲げて品質文化(Quality Culture)の醸成を推進し、それぞれの事業会社が特性に合わせた品質方針を策定しています。トップマネジメントのもと、一人ひとりが大塚の品質の担い手として継続的に製品・サービスの品質向上をめざして取り組んでいます。
品質文化(Quality Culture)の醸成

「品質は工場の生命にして包装も亦(また)品質なり 買う身になりて 造れ売れ」
1946年に大塚グループが注射薬の製造販売を開始するにあたり、製造、運送、販売に従事する人々が必ず実行すべき事柄であると、創業者が書に示しました。
大塚グループは生命関連企業として、すべての人々に信頼される安全・安心な製品を安定供給するために、常に顧客目線でニーズを探索し、リスクの把握に努め、技術の開発・取得、人財育成を進め、継続的な品質改善を行い、顧客満足の追求に努めています。
製造工程ごとの品質管理試験の実施とデータの信頼性確保
大塚グループでは、製品の品質に影響を与え得るすべての要素について明確な基準のもと、徹底した品質管理・品質保証を行っています。原材料・資材の受け入れから製品の出荷までの各工程ごとに 品質管理試験を実施し、製造工程ごとの品質管理試験に合格しなければ次の工程に進めないという、 厳格な基準を設けています。品質管理試験で得られたデータはシステム内で一元管理され、不正に修正・削除されることがない厳しいシステム管理を行い、すべてのデータの信頼性確保に努めています。
トレーサビリティ*の徹底
大塚グループ各社では、トレーサビリティ体制を整え、自社製造品および委託製造品に用いられたすべての情報をつなぎ、製品をロット単位で監視しています。原材料・資材の品質チェックから、製造工程の監視、品質管理試験などを通じて、問題が起こる前に対応策を考え、継続的に評価・改善を行うことで、安全・安心な製品の安定供給に努めています。
- *原材料・部品の調達から加工、組立、流通、販売の各工程で製造者・仕入先・販売元などを記録し、履歴を追跡可能な状態にしておくこと
品質管理・保証のための明確な基準と厳格な監査手順
大塚グループでは、適正な品質マネジメントを徹底するために、内部監査や当局からの自社工場査 察対応に加え、原材料のサプライヤーや製造委託先などのビジネスパートナーに対し、定期的な監査を行っています。ビジネスパートナーへの監査では、現地調査または書面調査を通じて規制遵守状況を確認し、指摘事項のレベルに応じた改善対応を経て、より良い品質を実現するためのパートナーシップ 形成に努めています。リスクの大きいトラブルに直面した場合は臨時の現地監査を行い、迅速な問題解決を図ります。
医療関連事業部門の推進体制
法規制などの要求事項に対して国際基準での製品品質の維持・向上と機能性の追求、安定供給を目指しています。例えば大塚製薬では「医薬品品質保証のための基本方針」を策定し、基本方針に従った活動を外部製造委託先を含む全工程で遵守することで、高いレベルでの品質保証システムの確立に努めています。2017年に「大塚グループ グローバル品質ポリシー」を策定し、品質データの信頼性確保の取り組みや統一手順書の作成などグローバルに活動を行っています。
推進体制
大塚グループの医療関連部門では、医薬品医療機器等法など各国の法規を遵守するとともに、製造販売においてGQP※1やGVP※2に基づく品質管理、製造販売後の安全管理を行い、規制当局への報告や各種文書の整備、改定を行っています。また、副作用などの製品の安全性を絶えず収集・評価する安全性監視(PV※3)をグローバルで実施できる体制を構築し、その結果を医療機関などに迅速に提供する活動を続けています。
また、高品質な医薬品を安定供給するために、すべての医薬品を適切な品質保証体制のもとで製造しています。各国GMP※4やPIC/S GMP※5といったグローバルな規制に準拠した品質保証体制を確立しているほか、「ICH Q 10医薬品品質システムに関するガイドライン」に基づいた品質システムを強化しています。
例えば大塚製薬では、2023年に新たに医療機器の製造販売業の許可も取得し、より一層患者さんへの貢献を行うべく管理体制の変更も行いました。さらにグローバル供給される製品の品質保証の観点で、グループ間での原材料ベンダーの監査連携、グローバル各社との品質に関わる情報共有や安定供給のための連携も継続した活動として実施しています。
- ※1GQP:Good Quality Practiceの略で、製造販売品質保証基準のことです。GQPは医薬品医療機器等法に基づく厚生労働省の省令で、正式名称は、「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令」といいます。
- ※2GVP:Good Vigilance Practiceの略で、製造販売後安全管理の基準のことです。製造販売後調査(PMS)の中で、GPSPと並ぶ業務の一つで、医薬品や医療機器を製造販売した後に、安全管理情報を収集・検討し、必要な安全確保措置を講じるために必要なルールの構築を要求するものです。GVP省令は医薬品医療機器等法に基づく厚生労働省の省令で、正式名称は、「医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理に関する省令」といいます。
- ※3PV:Pharmacovigilanceの略で、医薬品の安全性情報監視のことです。医薬品の副作用を検出、評価、予防することにより、適切な医薬品の使用を促し、患者さんの安全を守るものです。
- ※4GMP:Good Manufacturing Practiceの略で、原料の受入れから最終製品の出荷に至るまでの全工程において、適正な製造管理と品質管理を求める基準です。GMPは医薬品医療機器等法に基づく厚生労働省の省令で、正式名称は、「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」といいます。
- ※5PIC/S GMP:Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Schemeの略で医薬品査察協定及び医薬品査察共同スキームを意味します。医薬品分野での調和されたGMP基準及び査察当局の品質システムの国際的な開発・実施・保守を目的とした査察当局間の非公式な協力の枠組みです。
安全性管理
大塚グループでは、医薬品医療機器等法で定められた医薬品などの品質管理に関する業務を行う品質保証責任者、製造販売後安全管理に関する業務を行う安全管理責任者並びにこれらを統括する総括製造販売責任者を任命し、安全性管理体制を確立。品質及び安全性に関する業務を的確に行っております。また、総括製造販売責任者から経営層への報告会を毎月実施しています。
医薬品の製造販売における三役体制
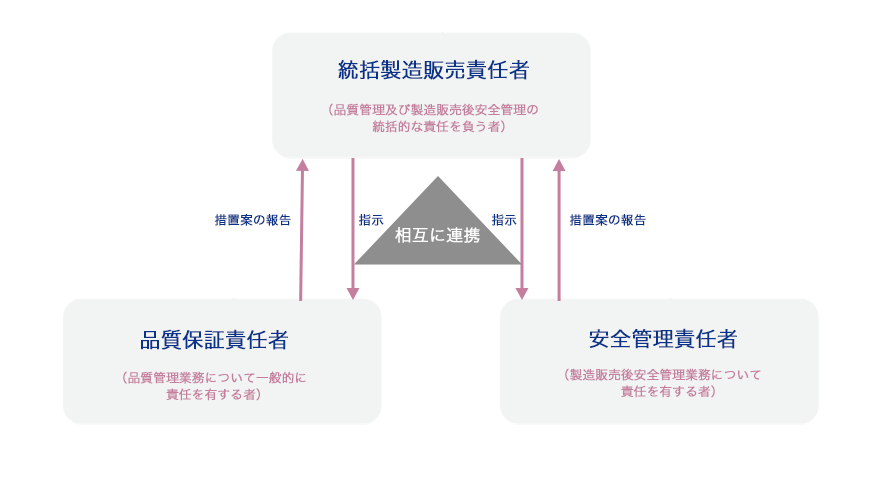
大塚製薬とそのグループ会社では、開発から販売品までのコンプライアンスのさらなる推進のための活動を2016年から実施しています。年3回のマネジメントへのレビューのほか、品質担当取締役への報告会は毎月実施しています。また、ニュートラシューティカルズ事業部では、品質担当取締役への報告会と品質保証定例会議を毎月実施し、徹底した品質マネジメント体制を整えています。
偽造医薬品防止のための啓発活動と撲滅活動への参画
世界各地での偽造医薬品※1や盗難に関連する事件が2021年において5,987件報告され、2020年と比べ38%の増加が確認されています※2。また途上国では医薬品流通量の10~30%が偽物であると報告されるなど、患者さんの安全性が大きく脅かされています。大塚製薬では、製薬防護研究所(PSI:Pharmaceutical Security Institute)との協働による偽造医薬品防止のための啓発活動および撲滅活動へ参画しています。※3大塚製薬と海外子会社は、適切な流通経路を通じた医薬品が患者さんの手に届くよう、市場監視や業界、行政と連携するグローバルプロダクトセキュリティチームを組織しています。2021年1月からは体制を強化し、生産・品質・調達・物流の各部門から専門性を有するメンバーが参画し組織横断的に活動しています。
- ※12017年のWHO総会において「偽造医薬品」の定義が議論され、WHOは同一性、組成や出所起源に関して、故意に/不正に偽造表示された医薬品を(Falsified Medicine)と定義しました。
- ※2製薬防護研究所(PSI:Pharmaceutical Security Institute)ホームページより。
- ※32023年において世界の製薬企業40社以上が製薬防護研究所(PSI)の偽造医薬品対策活動(情報収集、法執行との連携、啓発活動)に対し資金助成しています。
グローバル品質保証責任者会議
大塚製薬工場では、「富める人から貧しい人まで等しく医療を受けられるように、その国や地域にあった適正な価格で医薬品を提供したい」という考えのもと、現地での輸液製造にこだわっています。その製造には「大塚グローバル品質基準」を設定し、どの国においても高い品質を維持すること、そしてそのさらなる向上を目指しています。また、当社の若い技術者を責任者として現地へ派遣することで、社員自身も大きく成長する機会となっています。輸液事業を行うグループ会社15社(10カ国)で毎年グローバル品質保証責任者会議を開催しています。医薬品の中でも、輸液は直接体内に投与されることからより厳しい品質管理が求められています。グローバルで安全性情報の交換体制の構築とともに品質保証に対する考え方の統一を図りながら、グループ会社一体となって、常に品質の維持・向上に努めています。
医薬品の品質・安全性に対する監査
大塚グループでは、医薬品の品質ならびに安全性に関する国内外の法規制に基づき内部・外部監査を定期的に実施しています。
例えば、大塚製薬では、国内では国内規制に基づき薬事監査室による自己点検を年に1回実施しているほか、グローバルのQA(Quality Assurance:信頼性保証)部門が手順書の規程に基づいた社内監査を実施しています。また、外部監査については、各国の規制当局による査察のほか、医薬品の提携会社の監査部門ならびに外部のコンサルタント等による監査を受けています。
品質・安全性への取り組み|大塚製薬 (otsuka.co.jp)
医薬関連会社による合同ビジネスパートナー監査
大塚グループでは医薬品を製造する4社が協力し、原材料などの同一供給元に対するビジネスパートナー監査を合同で行っています。この活動は2016年から開始された独自の取り組みであり、監査員を育成するための教育プログラム、監査員認定制度なども共通の仕組みとして、運用しています。

大塚製薬
信頼性保証本部長
表 恭正
「合同ビジネスパートナー監査の活動」
大塚グループの医薬関連会社による合同の取り組みを通じて、ビジネスパートナー監査の均質化と監査担当者のスキルアップの両立が図れるようになりました。また、近年の品質不祥事への対応としても機能しており、原材料供給パートナーとのより強固な信頼関係構築にもつながっています。
神戸分析センターの設立(大塚製薬)

大塚製薬では、事業の拡大に伴い増加した国内外の委託 製造品を自社内で品質管理するための体制を構築するために、2023年8月に神戸に分析センターを設立しました。当センターでは、医療用医薬品とNC関連事業製品両方の 質管理に対応し、製薬企業としての厳格な品質管理体制を活かし、NC関連事業製品においても高いレベルの品質管理体制を維持しています。今後、デジタル技術やロボティクス、AI技術等の新たな技術の開発・取得とともに人財育成を進めていきます。
ニュートラシューティカルズ関連事業部門の推進体制

大塚製薬ではさらなる品質向上と安全性管理のために、2018年に品質本部を設立し、グループ15社を含むグローバル品質チームで共通の品質理念を確立すべく、2021年に「NC Global Quality Policy」を制定しました。
推進体制
大塚製薬では品質保証室を設け、グループ15社を含むグローバル品質チームが医薬品のGMPの考え方をもとに、リスクの抽出と検証およびトラブルが発生した際の原因究明と対応までを一元管理する仕組みを構築しました。バリューチェーンのすべてにおいて品質リスクを未然に防止することを目的に、「NC製品における開発から上市までの品質評価規定」を2020年12月に策定しました。
またグローバルな品質保証のために生産拠点における国際認証の取得を進めるなど、一層の品質向上を推進しています。
ニュートラシューティカルズ事業製品の品質・安全性に対する監査
大塚製薬のニュートラシューティカルズ事業部門では、食品安全の国際認証であるFSSC22000を取得している工場において、外部の監査機関による毎年の維持審査と3年に1回の更新審査※を受けています。
品質・安全性への取り組み|大塚製薬 (otsuka.co.jp)
お客様の声を聴く会の開催
大塚製薬では、ニュートラシューティカルズ関連製品の販売後の製品情報の収集に努めており、お客様相談室に届いたお客さまの声は、毎月の品質本部品質保証室の会議で生産や技術の関係部門と共有し、製品の改善検討と進捗確認を行っています。2018年からは規模を拡大した「お客様の声を聴く会」も年に1回開催し、調達部門、生産部門、品質部門のほかコンプライアンス部門や法務部門ほか大塚ホールディングスの担当者が情報を共有し、お客さま視点での品質の向上に努めています。
医薬関連事業とニュートラシューティカルズ関連事業の協働による品質向上の取り組み
年に1回開催している、グループ横断の「グローバル品質・生産・供給・環境会議」の中で、あるべき「品質経営」の実現に向けたグループ各社の品質活動について共有するとともに、優れた取り組みを表彰することで、品質管理人材の育成と意識向上に努めています。
人材育成と教育体制
大塚グループでは、品質に関わる全社員に対し、年間計画に従った定期研修を行っているほか、会社および工場のルールに関する教育、安全衛生・環境に関する教育、製品およびその製造にかかわる製造管理・品質管理に関する教育などを実施しています。内容に応じて、手順指導や実技の実施による教育により人材育成を行っています。
例えば大塚製薬では、新規採用者教育や入社2~3年目の社員を対象としたスキルアップ研修のほか試験確認者研修をそれぞれ年間約10回ずつ実施しています。そのほか、品質保証部門では、相互人材交流を通じてグローバルに活躍できる人材の育成ならびに双方の地域の歴史・文化を理解することを目的に、海外関連会社とのExchange Programを企画、実行しています。









